Окисление металлов, известное также как коррозия, – это фундаментальный процесс, определяющий их долговечность и применение в различных отраслях промышленности. Этот процесс включает в себя взаимодействие металла с окружающей средой, чаще всего с кислородом, приводящее к образованию оксидов и других соединений. Понимание того, какой металл легче всего окисляется, имеет решающее значение для выбора подходящих материалов для конкретных условий эксплуатации, а также для разработки эффективных методов защиты от коррозии. В этой статье мы подробно рассмотрим факторы, влияющие на окисление металлов, сравним реакционную способность различных металлов и обсудим методы предотвращения коррозии.
Факторы, влияющие на окисление металлов
Скорость и степень окисления металлов зависят от множества факторов, включая:
- Природа металла: Некоторые металлы, такие как золото и платина, обладают высокой устойчивостью к окислению, в то время как другие, например, щелочные металлы, очень легко окисляются.
- Наличие кислорода: Кислород является основным окислителем, поэтому его концентрация в окружающей среде играет важную роль.
- Влажность: Вода способствует электрохимической коррозии, особенно в присутствии растворенных солей.
- Температура: Повышение температуры обычно ускоряет процесс окисления.
- pH среды: Кислая или щелочная среда может значительно ускорить коррозию.
- Наличие примесей: Примеси в металле или в окружающей среде могут влиять на скорость и характер коррозии.
- Механические напряжения: Напряжения в металле могут повысить его восприимчивость к коррозии.
Ряд активности металлов и окисляемость
Ряд активности металлов, также известный как электрохимический ряд напряжений, представляет собой упорядоченный список металлов по их способности отдавать электроны в водных растворах. Чем выше металл в этом ряду, тем легче он окисляется и тем сильнее является восстановителем. Вот упрощенный вариант ряда активности:
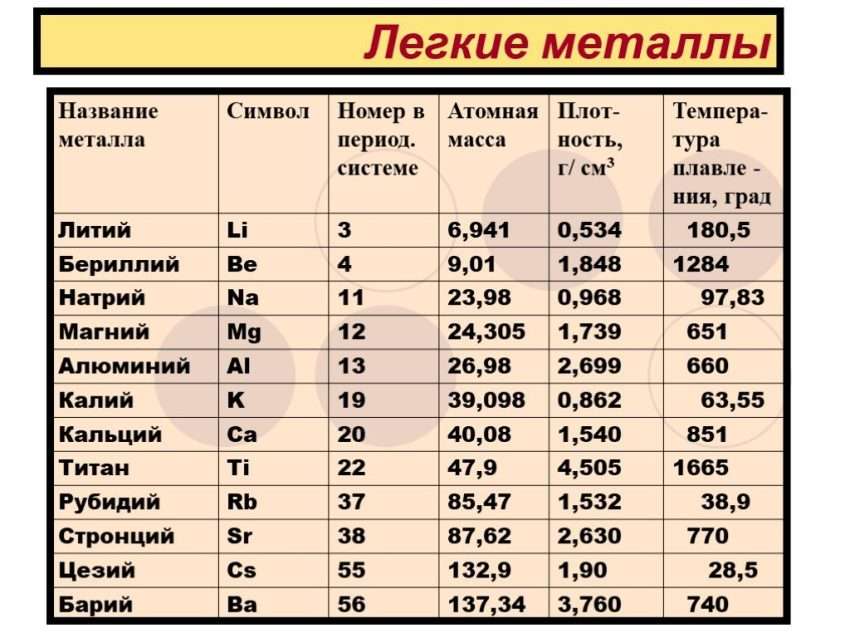
- Литий (Li)
- Калий (K)
- Кальций (Ca)
- Натрий (Na)
- Магний (Mg)
- Алюминий (Al)
- Цинк (Zn)
- Железо (Fe)
- Никель (Ni)
- Олово (Sn)
- Свинец (Pb)
- Водород (H)
- Медь (Cu)
- Серебро (Ag)
- Золото (Au)
- Платина (Pt)
Металлы, расположенные выше в ряду, легче окисляются, чем металлы, расположенные ниже. Например, литий (Li) легко отдает электроны и образует ионы Li+, а золото (Au) практически не вступает в реакции окисления в обычных условиях.
Щелочные металлы: Самые легко окисляемые
Щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) являются самыми электроположительными элементами и, следовательно, наиболее легко окисляются. Они чрезвычайно активно реагируют с кислородом и водой, образуя оксиды и гидроксиды. Например, натрий (Na) мгновенно реагирует с кислородом воздуха, покрываясь слоем оксида, а калий (K) может даже воспламениться на воздухе.
Щелочноземельные металлы: Высокая реакционная способность
Щелочноземельные металлы (бериллий, магний, кальций, стронций, барий, радий) также обладают высокой реакционной способностью, хотя и несколько меньшей, чем щелочные металлы. Они также легко окисляются, образуя оксиды. Магний (Mg), например, горит ярким пламенем на воздухе, образуя оксид магния (MgO).
Алюминий: Парадоксальная устойчивость
Алюминий (Al) – это металл, который легко окисляется, но при этом обладает хорошей устойчивостью к коррозии. Это связано с тем, что на поверхности алюминия быстро образуется тонкая, плотная и прочная оксидная пленка (Al2O3), которая защищает металл от дальнейшего окисления. Эта пленка самовосстанавливается при повреждении, что обеспечивает долговечность алюминиевых конструкций.
Железо: Распространенная коррозия
Железо (Fe) – это металл, который подвержен коррозии, известной как ржавление. Ржавление – это процесс окисления железа в присутствии кислорода и воды, приводящий к образованию гидратированного оксида железа (Fe2O3·nH2O), который является пористым и не защищает металл от дальнейшей коррозии. Поэтому железные конструкции требуют специальных мер защиты от коррозии, таких как покраска, гальванизация или использование легирующих элементов.
Благородные металлы: Исключительная устойчивость
Благородные металлы (золото, серебро, платина, палладий, родий, иридий, осмий, рутений) обладают высокой устойчивостью к окислению и коррозии. Они не реагируют с кислородом и водой в обычных условиях и сохраняют свой блеск и свойства в течение длительного времени. Благодаря этим свойствам они широко используются в ювелирном деле, электронике и других областях, где требуется высокая надежность и долговечность.
Сравнение окисляемости различных металлов
Для наглядного сравнения окисляемости различных металлов можно использовать следующую таблицу:
| Металл | Окисляемость | Примеры применения |
|---|---|---|
| Литий (Li) | Очень высокая | Аккумуляторы, химические источники тока |
| Натрий (Na) | Очень высокая | Производство химических веществ, теплоноситель |
| Магний (Mg) | Высокая | Легкие сплавы, пиротехника |
| Алюминий (Al) | Средняя (с образованием защитной пленки) | Авиация, строительство, упаковка |
| Цинк (Zn) | Средняя | Гальванизация, производство батарей |
| Железо (Fe) | Средняя (подвержено ржавлению) | Строительство, машиностроение |
| Медь (Cu) | Низкая | Электротехника, водопроводные трубы |
| Серебро (Ag) | Очень низкая | Ювелирные изделия, электроника |
| Золото (Au) | Исключительно низкая | Ювелирные изделия, электроника, стоматология |
| Платина (Pt) | Исключительно низкая | Катализаторы, ювелирные изделия, медицинское оборудование |
Методы защиты от коррозии
Существует множество методов защиты металлов от коррозии, которые позволяют продлить срок их службы и обеспечить надежную работу конструкций и оборудования. Выбор конкретного метода зависит от условий эксплуатации, типа металла и требуемой степени защиты. Вот некоторые из наиболее распространенных методов:
- Покраска: Нанесение защитного лакокрасочного покрытия, которое предотвращает контакт металла с окружающей средой.
- Гальванизация: Покрытие металла слоем цинка, который защищает его от коррозии, даже если покрытие повреждено.
- Анодирование: Создание на поверхности металла толстой оксидной пленки, которая обеспечивает дополнительную защиту от коррозии.
- Катодная защита: Подключение к металлу более электроотрицательного металла (протектора), который принимает на себя коррозионный ток.
- Легирование: Добавление в металл легирующих элементов, которые повышают его устойчивость к коррозии. Например, добавление хрома в сталь делает ее нержавеющей.
- Ингибиторы коррозии: Добавление в окружающую среду веществ, которые замедляют или предотвращают коррозию.
- Использование защитных атмосфер: Создание вокруг металла атмосферы, не содержащей кислорода и других агрессивных веществ.
Коррозия в различных отраслях промышленности
Коррозия является серьезной проблемой во многих отраслях промышленности, приводящей к огромным экономическим потерям и угрозам безопасности. Например, в нефтегазовой промышленности коррозия трубопроводов и оборудования может привести к утечкам и авариям. В транспортной отрасли коррозия кузовов автомобилей и корпусов судов снижает их долговечность и безопасность. В энергетике коррозия паровых турбин и теплообменников снижает эффективность работы электростанций. В строительстве коррозия арматуры в железобетонных конструкциях может привести к их разрушению.
Примеры коррозии в различных средах
- Морская вода: Морская вода содержит большое количество солей, которые ускоряют электрохимическую коррозию. Особенно подвержены коррозии сталь, алюминий и медь.
- Атмосфера: Атмосферная коррозия зависит от влажности, температуры и наличия загрязняющих веществ, таких как диоксид серы и оксиды азота. Железо подвержено ржавлению, а медь – образованию патины.
- Почва: Коррозия в почве зависит от ее состава, влажности, pH и наличия микроорганизмов. Подземные трубопроводы и кабели подвержены коррозии под воздействием почвенной среды.
- Химические среды: Коррозия в химических средах зависит от типа и концентрации химических веществ. Кислоты и щелочи могут значительно ускорить коррозию многих металлов.
Будущее исследований в области коррозии
Исследования в области коррозии продолжают развиваться, направленные на разработку новых материалов и методов защиты от коррозии. Особое внимание уделяется созданию самовосстанавливающихся покрытий, наноматериалов с повышенной устойчивостью к коррозии и экологически безопасных ингибиторов коррозии. Также активно исследуются методы прогнозирования коррозии и мониторинга состояния металлических конструкций с использованием датчиков и неразрушающих методов контроля.
Влияние коррозии на окружающую среду
Коррозия не только приводит к экономическим потерям, но и оказывает негативное воздействие на окружающую среду. Продукты коррозии могут загрязнять почву и воду, а также приводить к выбросам вредных веществ в атмосферу. Использование токсичных ингибиторов коррозии и методов защиты, загрязняющих окружающую среду, также представляет серьезную проблему. Поэтому разработка экологически безопасных методов защиты от коррозии является важной задачей.