Цели урока:
- рассказать ученикам о молекулах и атомах и научить различать их.
Задачи урока:
Обучающие: изучить новый материал по теме «Молекулы и атомы»;
Развивающие: содействовать развитию мышления и познавательных умений; овладению методами синтеза и анализа;
Воспитательные: воспитание положительной мотивации к обучению.
Основные термины:
Молекула – нейтральная электрически частица, которая состоит из двух и более атомов, связанных ковалентными связями; наименьшая частица вещества, которая обладает его свойствами.
Атом – самая маленькая неделимая химически часть элемента, которая является носителем его свойств; состоит из электронов и атомного ядра. Различное количество разных атомов, связанных межатомными связями, образуют молекулы.
Атомное ядро – центральная часть атома, в которой сосредоточено более 99,9% его массы.
3.Почему не видны частицы, из которых состоит вещество ?
4.Как объяснить высыхание белья после стирки?
5.Почему твердые тела, состоящие из частиц, кажутся сплошными?
Молекулы.
2.Как называются частицы, из которых состоят молекулы?
3.Опишите опыт, с помощью которого можно определить размер молекулы.
4.Различаются ли молекулы одного вещества в его различных агрегатных состояниях?
5.Что такое атом и из чего он состоит
Домашнее задание.
Попробуйте провести дома опыт по измерению размера молекулы любого вещества.
Интересно знать, что.
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами. В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX - начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является «неделимым».
На международном съезде химиков в г. Карлсруэ (Германия) в 1860 г. были приняты определения понятий молекулы и атома. Атом - наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Физика атомов и молекул - раздел физики, изучающий внутреннее строение и физические свойства атомов, молекул и их более сложных объединений (кластеров), а также физические явления при низкоэнергетических элементарных актах взаимодействия объектов между собой с элементарными частицами.
При изучении физики атомов и молекул основными являются такие экспериментальные методы как спектроскопия и масс-спектрометрия со всеми их разновидностями, некоторые виды хроматографии, резонансных методов и микроскопии, теоретические методы квантовой механики, статистической физики и термодинамики. Физика атомов и молекул тесно взаимосвязана с молекулярной физикой, в которой изучаются (коллективные) физические свойства тел в различных агрегатных состояниях на основе рассмотрения их микроскопического строения, а также с некоторыми разделами химии.
Давайте проведем краткий экскурс в историю развития атомно-молекулярной теории:
Список литературы
1.Урок на тему «Молекулы и атомы» С.В. Громов, И.А. Родина, учителя физики.
2.Урок на тему «Строение вещества» Фонин Илья Александрович, Камзеева Елена Евгеньевна, учитель физики, МОУ Гимназия №8, г.Казань.
3.Г. Остер. Физика. Задачник. Ненаглядное пособие.- М.: Росмэн, 1998.
4.Мейяни А. Большая книга экспериментов для школьников. М.: «Росмен». 2004 г.
5.Global Physics «Атомы и молекулы».
Отредактировано и выслано Борисенко И.Н.
Над уроком работали:
Громов С.В.
Фонин И.А.
Атомы – очень маленькие частицы, их размер лежит в пределах от одного до пяти ангстрем (обозначается – Аo .). Один ангстрем – это 10–10 метра. Размер кристаллика сахара приблизительно 1 мм, такой кристаллик больше любого из входящих в его состав атомов примерно в 10 миллионов раз. Чтобы лучше представить себе, насколько маленькими частичками являются атомы, рассмотрим такой пример: если яблоко увеличить до размеров земного шара, то атом, увеличенный во столько же раз, станет размером со среднее яблоко.
Несмотря на столь малые размеры, атомы представляют собой довольно сложные частицы. Со строением атомов вы познакомитесь в этом году, а пока скажем только, что любой атом состоит из атомного ядра и связанной с ним электронной оболочки , то есть тоже представляет собой систему.
В настоящее время известно чуть более ста видов атомов. Из них устойчиво около восьмидесяти. И из этих восьмидесяти видов атомов построены все окружающие нас объекты во всем их бесконечном многообразии.
Одной из важнейших особенностей атомов является их склонность соединяться друг с другом. Чаще всего при этом образуются молекулы .
Молекула может содержать от двух до нескольких сотен тысяч атомов. При этом маленькие молекулы (двухатомные, трехатомные...) могут состоять и из одинаковых атомов, а большие, как правило, состоят из разных атомов. Так как молекула состоит из нескольких атомов и эти атомы связаны, молекула представляет собой систему.В твердых и жидких телах молекулы связаны друг с другом, а в газах – не связаны.
Связи между атомами называются химическими связями , а связи между молекулами – межмолекулярными связями .
Связанные между собой молекулы образуют вещества .
Вещества, состоящие из молекул, называются молекулярными веществами . Так, вода состоит из молекул воды, сахар – из молекул сахарозы, а полиэтилен – из молекул полиэтилена.
Кроме этого,многие вещества состоят непосредственно из атомов или других частиц и не содержат в своем составе молекул. Например, не содержат молекул алюминий, железо, алмаз, стекло, поваренная соль. Такие вещества называются немолекулярными .
В немолекулярных веществах атомы и другие химические частицы, как и в молекулах, связаны между собой химическими связями.Деление веществ на молекулярные и немолекулярные – это классификация веществ по типу строения .
Принимая, что связанные между собой атомы сохраняют шарообразную форму, можно построить объемные модели молекул и немолекулярных кристаллов. Примеры таких моделей приведены на рис. 1.1.
Большинство веществ обычно находится в одномиз трех агрегатных состояний : твердом, жидком или газообразном. При нагревании или охлаждении молекулярные вещества могут переходить из одного агрегатного состояния в другое. Такие переходы схематически показаны на рис. 1.2.
Переход немолекулярного вещества из одного агрегатного состояния в другое может сопровождаться изменением типа строения. Чаще всего это явление происходит при испарении немолекулярных веществ.
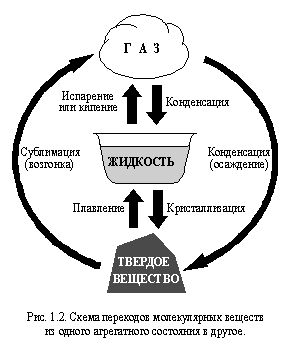
При плавлении,кипении,конденсации и тому подобных явлениях, происходящих с молекулярными веществами, молекулы веществ не разрушаются и не образуются. Рвутся или образуются только межмолекулярные связи. Например, лед при плавлении превращается в воду, а вода при кипении – в водяной пар. Молекулы воды при этом не разрушаются, и, следовательно, как вещество вода остается неизменной. Таким образом, во всех трех агрегатных состояниях это одно и то же вещество – вода.
Но далеко не все молекулярные вещества могут существовать во всех трех агрегатных состояниях. Многие из них при нагревании разлагаются , то есть превращаются в другие вещества, при этом разрушаются их молекулы. Например, целлюлоза (основная составная часть древесины и бумаги) при нагревании не плавится, а разлагается. Ее молекулы разрушаются, а из "осколков" образуются совсем другие молекулы.
Итак,молекулярное вещество остается самим собой, то есть химически неизменным, до тех пор, пока сохраняются неизменными его молекулы.
Но вы знаете, что молекулы находятся в постоянном движении. И атомы, из которых состоят молекулы, тоже движутся (колеблются). При повышении температуры колебания атомов в молекулах усиливаются. Можем ли мы сказать, что молекулы остаются полностью неизменными? Конечно, нет! Что же тогда остается неизменным? Ответ на этот вопрос – в одном из следующих параграфов.
Вода. Вода – самое известное и весьма распространенное вещество на нашей планете: поверхность Земли на 3 /4 покрыта водой, человек на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе протекают все клеточные процессы организма. Вода – молекулярное вещество. Это одно из немногих веществ, которое в природных условиях встречается в твердом, жидком и газообразном состояниях, и единственное вещество, для которого в каждом из этих состояний есть свое название. Особенностями строения воды вызваны ее необычные свойства. Например, при замерзании вода увеличивается в объеме, поэтому лед плавает в своем расплаве – жидкой воде, а наибольшая плотность воды наблюдается при 4 o С, поэтому зимой большие водоемы до дна не промерзают. На свойствах воды основана и сама шкала температур Цельсия (0 o – температура замерзания, 100 o – температура кипения). С причинами этих явлений и с химическими свойствами воды вы познакомитесь в 9-м классе. |
Железо – серебристо-белый, блестящий, ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает второе место после алюминия по распространенности в природе и первое место по значению для человечества. вместе с другим металлом – никелем – оно образует ядро нашей планеты. Чистое железо не имеет широкого практического применения. Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX в. до н. э.) – один из немногих примеров использования чистого железа (99,72 %); возможно, что именно чистотой материала и объясняется долговечность и коррозионная устойчивость этого сооружения. В виде чугуна, стали и других сплавов железо используется буквально во всех отраслях техники. Его ценные магнитные свойства используются в генераторах электрического тока и электромоторах. Железо является жизненно необходимым элементом для человека и животных, так как оно входит в состав гемоглобина крови. При его недостатке клетки тканей получают недостаточно кислорода, что ведет к очень тяжелым последствиям. |
Как вы уже знаете, атомы бывают одинаковые и разные. Чем разные атомы отличаются друг от друга по строению, вы скоро узнаете, а пока скажем только, что разные атомы отличаются химическим поведением , то есть своей способностью соединяться друг с другом, образуя молекулы (или немолекулярные вещества).
Иными словами, химические элементы – это те самые виды атомов, которые упоминались в предыдущем параграфе.
Каждый химический элемент имеет свое название, например: водород, углерод, железо и так далее. Кроме того, каждому элементу присвоен еще и свой символ . Эти символы вы видите, например, в " Таблице химических элементов" в школьном кабинете химии.
Химический элемент – абстрактная совокупность. Так называют любое число атомов данного вида, причем атомы эти могут находиться где угодно, например: один – на Земле, а другой – на Венере. Химический элемент нельзя ни увидеть, ни пощупать руками. Атомы, образующие химический элемент, могут быть как связаны, так и не связаны друг с другом. Следовательно, химический элемент не является ни веществом, ни материальной системой.
Все вещест-ва могут быть твёрдыми, жидкими и газооб-разными. Вода, лёд, водяной пар — всё это разные состояния одного и того же вещест-ва — воды. Что же происходит с водой, когда мы её охлаждаем или нагреваем? Почему так меняются её свойства?
Все вещества состоят из множества мельчайших частиц — молекул и ещё более мелких частичек — атомов. От их взаимодействия и зависят все свойства веществ. Атомы и молекулы называют частицами вещества .
Их можно обнаружить только с помощью сложных приборов. По своим свойствам они очень разнообразны. Сахар состоит из одних час-тиц, соль — из других, вода — из третьих. В каждом веществе огромное количество моле-кул, а атомов ещё больше.
Вещества бывают разные. В природе мы встре-чаем не только чистые вещества, которые состо-ят из одинаковых частиц вещества (вода, соль, сахар). Попробуем смешать воду и чернила.
Какое получилось вещество? Эту жидкость нель-зя назвать ни водой, ни чернилами. Это смесь.
Вещество в природе очень часто бывает в состоянии смеси. Например, почва. Она состо-ит из мельчайших комочков глины и из более крупных песчинок и камней. А ещё в неё входят перегнившие остатки растений. Поч-ва — смесь веществ.
Обычный воздух — тоже смесь: в нём много разных газов. Там есть кислород, которым ды-шат все живые организмы. Есть углекислый газ, который поглощают растения для образования питательных веществ. Есть в воздухе и пыль.
Почему же твёрдые тела, жидкости и газы так не похожи друг на друга? Может, их час-тицы ведут себя по-разному? Ведь именно от взаимоотношений мельчайших атомов и моле-кул должны зависеть свойства веществ.
В твёрдых телах все частицы крепко при-жаты друг к другу. Такое расположение напо-минает физкультурников на параде.
В жидкостях частицы свободно перемещают-ся относительно друг друга, как люди на ули-це. Поэтому жидкости текут, ведь можно ска-зать, что и толпа «течёт» по улице.
В газах частицы очень далеки друг от дру-га, как редкие прохожие ранним утром. По-этому газы легко сжимаются, уплотняются. Материал с сайта
В твёрдых телах частички как бы держатся друг за друга. Чтобы их расцепить и превра-тить твёрдое тело в жидкость, нужно его на-греть, то есть добавить тепла. А если тепла добавить ещё больше, то частички начнут бы-стро двигаться и разбегаться в разные сторо-ны. В результате жидкость превратится в газ. Вспомни, что происходит, когда люди забыва-ют снять с плиты кипящий чайник. Вся вода в нём выкипает — превращается в газ и мель-чайшие капельки воды.
А что происходит, когда мы охлаждаем воду в холодильнике? Лишённые тепла, частички начинают соединяться друг с другом — уплот-няться, и вода превращается в твёрдый лёд.
На этой странице материал по темам:
Реферат тела и вещества
Что из чего состоит. тела, атомы, молекулы, вещества
Из чего состоят вещества и как ведут себя частицы
-
Строение вещества. 7-й класс
Малиновская Наталья Васильевна , преподаватель физики
Статья отнесена к разделу: Преподавание физики
Тип урока: урок изучения нового материала
Цели урока:
Образовательные: изучить смысл понятий – вещество, простые вещества, сложные вещества, молекула (атом); изучить состав молекул (водород, кислород, вода).
Развивающие: развивать наблюдательность, грамотную речь, формировать умение делать выводы из наблюдений.
Воспитывающие: воспитывать интерес к изучению физики, трудолюбие на примере из жизни ученых
Оборудование : Приборы и материалы для демонстрационного и фронтального экспериментов: стакан с водой, 3 пустых стакана, стальной шарик, кольцо, спиртовка, акварельные краски, масло, стакан воды, воздушный шарик, колба с водой, пробкой и стеклянной трубкой, штатив,несколько моделей кристаллических решеток; для каждого ученика – салфетка, пузырек со спиртом (одеколоном), стакан с водой, крупинка марганцовки,5 маленьких сосудов, стакан с чистой водой, модели молекул воды,пространственные кристаллические решетки.
Ход урока.
I. Организационный момент –
приветствие, подготовка класса к уроку; мотивация учебной деятельности.
II. Проверка знаний по пройденным ранее темам
1 . - фронтальный опрос
Что называется «физическим телом»? (каждое из окружающих нас тел )
Что называют «веществом» в физике? (то, из чего состоят физические тела )
Что такое «явление»? (изменения, происходящие с физическими телами )
Приведите примеры тел, назовите вещество, из которого состоит тело (стакан –стекло)
- Назовите физические явления (плавление льда, листопад, гроза)
- Что характеризует температура? Каким прибором она измеряется? (степень нагретости тела, измеряется термометром).
III. Изучение нового материала (метод – беседа с постановкой проблемных вопросов).
Вступительное слово учителя.
В древности большинство людей принимало мифические представления о мире как реальность, не вызывающую сомнений. Но уже в YI веке до н.э. некоторые люди перестали верить в мифы и стали самостоятельно размышлять над вопросами об окружающем мире и искать на них ответы.
Человек с давних времен пытался объяснить все загадочное, с чем встречался.Наблюдая за природой, он стремился раскрыть ее тайны. Вы, конечно же, ежедневно сталкиваетесь с различными физическими явлениями и в большинстве случаев можете предсказать, как они закончатся.Попробуйте предсказать результат:
если бросить мяч вверх, то он через некоторое время…
если капнуть каплю краски в стакан с водой, то …
если нагреть лед, то …
Окружающие нас тела имеют определенные свойства: кирпич твердый, а пластилин мягкий. При нагревании лед тает, превращается в воду. Почему это происходит? Как обычно отвечают люди на вопросы о природе вещей? Это что? Это гвоздь. А он из чего сделан? Из железа. А железо из чего сделано? Железо – из жедеза, и все. Предположим, что вам необходимо сконструировать космический корабль, который совершит полет в космос.Что нужно знать для этого? (Свойства материалов, из которых он должен состоять). А какие знания необходимо иметь для создания материалов с заданными свойствами? (надо знать строение вещества) .
Составление схемы строения вещества:
ТЕЛО - ВЕЩЕСТВО - ???
Постановка проблемного вопроса - КАКОВО СТРОЕНИЕ ВЕЩЕСТВА?
Сообщение темы и цели урока.
Проведем несколько опытов.
1 опыт. Сожмем руками воздушный шар. Что с ним произошло? (он уменьшился в объеме). Объясните, почему? (воздух состоит из частиц, между ними есть промежутки).
2 опыт (фронтальный) – учащимся предлагается капнуть на лист салфетки каплю пахучей жидкости (спирт, одеколон) и понаблюдать за пятном на бумаге, а затем объяснить, куда исчезло пятно. (спирт состоит из частиц, которые покинули поверхность салфетки)
3 опыт - Возьмем металлический шарик и кольцо.Легко ли проходит металлический шарик сквозь кольцо? (да ). Подержим его в пламени спиртовки. Проходит ли теперь шарик сквозь кольцо? (нет ).
Почему? (при нагревании увеличился объем тела )
4 опыт. Колбу с водой закроем пробкой, в которую вставлена узкая стеклянная трубка. При нагревании воды в колбе уровень воды в трубке повышается, при охлаждении - понижается. На этом основан принцип действия обычного термометра для измерения температуры. В трубке термометра находится ртуть или спирт. Вывод: При нагревании жидкости расширяются.
5 опыт (результат будем заносить в рабочую тетрадь по физике, 7 кл стр. 11.- деление вещества на мельчайшие частицы). Растворим маленькую крупинку марганцовки в воде, налитой в стакан. Отольём немного окрашенной воды в другой стакан и дольём в него чистую воду. Что наблюдаем? (раствор окрашен слабее ). Повторим предыдущее действие несколько раз. Что теперь наблюдаем? (Раствор окрашен ещё слабее). Каков был размер крупинки марганца? (онамаленькая). Какое основное свойство сохранились в растворе (окраска ).Что вы можетесказать о размерах частиц марганца, которые находятся в воде? (Они малы).
Сделайте вывод о строении вещества… Вещество состоит из отдельных частиц.
Каковы размеры этих частиц? Частицы, из которых состоят вещества.очень маленькие. Каково количество частиц даже в внебольшом количестве вещества? Частиц в веществе очень много.
Название мельчайшей частицы вещества - молекула.
Какую частицу называют молекулой? Молекула – мельчайшая частица вещества .
Молекула - от лат “moles” - масса с уменьшительным суффиксом “cula” - массочка. Сам термин появился в 1647 г. (фр. ученый Пьер Гассенди).
Самая малая частица воды – молекула воды. Самая малая частица соли – молекула соли. Молекулы сохраняют основные свойства вещества. Молекула соли – солёная. Молекула зеленой краски – зеленая.
А как вы думаете, молекулы различных веществ одинаковы или нет? (нет)
Что вы можете сказать о молекулах одного и того же вещества?Лед, вода и водяной пар состоят из одних и тех же молекул или нет? (да).
Почему? (Потому что это одно и то же вещество, но в разном виде).
Вывод: Молекулы разных веществ различны. Молекулы одного вещества одинаковы.
Каковы же размеры молекул? Известно, что из пшеницы получают муку. Капля масла, растекаясь по поверхности воды, может образовать плёнку, толщина которой в десятки тысяч раз меньше диаметра человеческого волоса. Но в крупинке воды и в толще масляной плёнки содержится не одна, а много молекул. Значит, размеры молекул этих веществ ещё меньше, чем размеры крупинки муки и толщина плёнки. Давайте попробуем представить их размеры. Молекула во столько раз меньше яблока среднего размера, во сколько раз яблоко меньше земного шара.
Можно ли увидеть молекулыс помощью наших органов зрения? (нет)
Почему? (их размеры очень малы).
Тем не менее, оказывается, есть частицы, из которых, в свою очередь, состоят и молекулы – они называются атомами.
Вывод: Молекулы состоят из атомов .
Завершение схемы строения вещества (записываем в тетрадь ):
ТЕЛО – ВЕЩЕСТВО – МОЛЕКУЛЫ – АТОМЫ - ??? (продолжение следует…)
В рабочих тетрадях по физике 7 кл, стр. 12 учащиеся выполняют задание № 2 «Допишите предложения» - самостоятельно, с последующей проверкой.
Сведения из истории : (возможно выступление учащегося с заранее подготовленным материалом). Древнегреческий ученый Демокрит впервые высказал гениальное предположение о том, что все тела состоят из мельчайших неделимых и неизменных частичек - атомов, которые находятся в движении и, взаимодействуя между собой, образуют все тела природы. Наблюдая различные природные явления, Демокрит пришел к убеждению, что тела только кажутся нам сплошными, на самом же деле они состоят из мельчайших частиц, но они настолько малы, что увидеть их невозможно. Демокрит предполагал, что у различных тел эти частицы различны по форме. Он назвал эти мельчайшие частички “атомами”, что по-гречески означает “неделимые”. Таким образом, древние ученые высказали многое из современных представлений о строении вещества. В ту пору их высказывания являлись, конечно, лишь гениальными догадками, основанными на наблюдениях, но не подтвержденными никакими экспериментальными фактами.
Ответьте на вопрос: Мы не видим молекулы или атомы. Тела нам представляются сплошными. Каким же образом было доказано их существование? (на основании опытов и наблюдений высказывались гипотезы) . Только наука XX в. предоставила многочисленные прямые доказательства существования атомов и молекул. Атомы можно увидеть в самые современные электронные и ионные микроскопы!
Атомы каждого вида принято обозначать специальными символами. Например: (записываем на доске и в тетрадях): “О – атом кислорода, H – атом водорода».
Молекулы также обозначаются специальными символами. Объяснение строения молекул воды с применением модели: рассмотрение моделей молекул воды.
- Атомов в природе чуть больше 100, но их комбинации создают различные вещества, которое окружают нас. В природе 88 атомов, остальные получены в лабораториях. Существуют молекулы-гиганты, в которых содержатся тысячи и сотни тысяч атомов. Это молекулы полимеров. При помощи шариков можно конструировать модели молекул.
- М.В. Ломоносов (1711-1765) - великий просветитель и основатель науки в России,который своим титаническим трудом сделал очень много открытий во многих областях науки, писал, что молекула может быть однородной и разнородной.
Если какое-либо вещество состоит из одинаковых молекул, то его называют простым. Если вещество состоит из молекул, построенных из различных атомов, его называют сложным . Есть тела, молекулы которых состоят из одного атома (алмаз, графит), существуют молекулы, состоящие из двух атомов. Например: О 2 – молекула кислорода. Она состоит из 2-х атомов кислорода. Н 2 – молекула водорода. Она состоит из 2-х атомов водорода. Н 2 О – молекула воды. Она состоит из 2-х атомов водорода и одного атома кислорода. . Вместе с тем существуют молекулы-гиганты, в которых содержатся тысячи и сотни тысяч атомов. Это молекулы полимеров. При помощи шариков можно конструировать модели молекул. (Демонстрация пространственных кристаллических решеток).
В современном мире с использованием новейшего оборудования изучены свойства таких молекул-гигантов, из которых состоит вещество «фуллерен».Дополнительный материал: фуллерены - это совершенно новый тип молекулярной формы углерода. Учащийся может заранее подготовить небольшое сообщение с информацией об истории открытия фуллеренов, их структурных, физических и химических свойствах, а также области их применения.
Как вы считаете – атомы – это самые мельчайшие частицы вещества? (мнения могут разделиться, тогда учитель сам сообщает о строении атома). Существуют ещё более мелкие частицы (протоны, нейтроны, электроны), о которых вы узнаете в 8 классе.
Итог этапа изучения нового материала - с какими новыми понятиями вы сегодня встретились на уроке?
IV. Закрепление изученного(фронтальный опрос).
Из чего состоит вещество? (вещество состоит из частиц)
Почему частицы, из которых состоит вещество, нельзя наблюдать невооруженным глазом?, (они очень маленькие)
Что вы знаете о количестве частиц, составляющих вещество? (их очень много).
Что происходит с телами при их нагревании? При охлаждении? (при нагревании тела расширяются, при охлаждении – сжимаются)
Объясните эти утверждения с точки зрения внутреннего строения вещества.
Приведите примеры из своего жизненного опыта, доказывающие эти утверждение (учащиеся приводят примеры из своего опыта).
Выполнение заданий из сборника задач по физике, В.И. Лукашик №№ 40, 43, 44, 45, 49, 50 – устно- решение качественных задач.
V. Проверка усвоения изученного материала.
Кратковременная самостоятельная работа (с последующей самопроверкой и выставлением оценки за работу
5 верных ответов – оценка «5»
4 верных ответа – оценка «4»
3 верных ответа – оценка «3»
если 2 или 1 верный ответ –необходимо повторить изученный материал
Поставить на листочках с выданными заданиями «+», если ответ «да», «-», если ответ «нет».
I вариант
Вещество состоит из маленьких частиц, которые можно увидеть - (нет).
Молекулы холодной и горячей воды различны - (нет).
При нагревании вещества промежутки между его частицами увеличиваются + (да).
Атомы состоят из молекул - (нет).
Молекула водорода состоит из двух атомов водорода + (да)
II вариант
Объем тела при нагревании уменьшается - (нет).
При сжатии газа уменьшаются размеры молекул - (нет).
Молекулы водяного пара отличаются от молекул воды - (нет).
Молекулы состоят из атомов + (да).
Молекула кислорода состоит из двух атомов кислорода + (да)
V. Домашнее задание (с комментарием, дифференцированное)
Для всех - Изучить параграфы 7, 8, ответить на вопросы.
Для желающих - Изготовить модель молекулы воды
Провести опыт с каплей масла (лучше машинного) по определению размеров молекулы масла,
Написать мини-сочинение «В мире молекул».
VI. Итог урока.
Рефлексия (что было непонятно, что понравилось на уроке, что не понравилось?)
Выставление оценок за урок.
Литература:
Кабардин О.Ф. История развития физики и развитие представлений о мире: элективный курс: 10-11 класс: учеб.пособие / О.Ф.Кабардин. – М., Астрель: Транзиткнига, 2005. – 318, с,:ил.
Рабочая тетрадь по физике: 7 класс: к учебнику А. В. Пёрышкина «Физика 7 класс»/ Р. Д. Минькова, В. В. Иванова.-2-е изд., стереотип. – М.: Издательство «Экзамен», 2010. – 142, с.
Сборник задач по физике: 7-9 кл.: к учебникам А. В. Пёрышкина и др. «Физика. 7 класс», «Физика. 8 класс», «Физика. 9 класс»/ А. В. Пёрышкин; Сост. Н. В. Филонович.-5-е изд., стереотип. – М.: Издательство «Экзамен», 2010. – 190,
Сборник задач по физике. 7-9 классы: пособие для учащихся общеобразоват. учреждений / В. И. Лукашик, Е. В. Иванова. – 24-е изд. – М.: Просвещение, 2010. – 240 с.: ил.
Универсальные поурочные разработки по физике: 7 класс. – 2-е изд.,перераб. И доп. – М.: ВАКО, 2010. – 304 с. – (В помощь школьному учителю).
Физика. 7 кл.: учеб.для общеобразоват. учреждений/А. В. Пёрышкин. – 14-е изд., стереотип. – М. Дрофа, 2010. – 192 с.:ил.
