Objectifs de la leçon:
- parler aux élèves des molécules et des atomes et leur apprendre à les distinguer.
Objectifs de la leçon:
Éducatif : explorer nouveau matériel sur le thème « Molécules et atomes » ;
Développer : pour favoriser le développement des capacités de réflexion et cognitives ; maîtriser les méthodes de synthèse et d'analyse ;
Éducatif : éducation à la motivation positive pour l'apprentissage.
Termes de base :
Molécule- une particule électriquement neutre composée de deux ou plusieurs atomes liés des liaisons covalentes; la plus petite particule d'une substance qui a ses propriétés.
Atome- la plus petite partie chimiquement indivisible de l'élément, qui est porteuse de ses propriétés ; est composé d'électrons et d'un noyau atomique. Quantité variée différents atomes liés par des liaisons interatomiques forment des molécules.
noyau atomique- la partie centrale de l'atome, dans laquelle plus de 99,9% de sa masse est concentrée.
3. Pourquoi les particules qui composent substance?
4.Comment expliquer le séchage du linge après lavage ?
5. Pourquoi les corps solides constitués de particules semblent-ils solides ?
Molécules.
2. Quels sont les noms des particules qui composent les molécules ?
3. Décrivez une expérience qui peut être utilisée pour déterminer la taille d'une molécule.
4. Les molécules d'une substance diffèrent-elles dans ses divers états d'agrégation?
5. Qu'est-ce qu'un atome et en quoi consiste-t-il
Devoirs.
Essayez de mener une expérience à la maison pour mesurer la taille de la molécule de n'importe quelle substance.
C'est intéressant de le savoir.
Le concept d'un atome comme la plus petite partie indivisible de la matière a été formulé pour la première fois par les anciens philosophes indiens et grecs anciens. Aux XVIIe et XVIII siècles les chimistes ont pu confirmer expérimentalement cette idée en montrant que certaines substances ne peuvent plus être décomposées en leurs éléments constitutifs par des méthodes chimiques. Cependant, à la fin du 19e et au début du 20e siècle, les physiciens ont découvert les particules subatomiques et la structure composite de l'atome, et il est devenu clair que l'atome n'est pas vraiment « indivisible ».
Au congrès international des chimistes de Karlsruhe (Allemagne) en 1860, les définitions des concepts de molécule et d'atome sont adoptées. Atome - la plus petite particule d'un élément chimique, qui fait partie de substances simples et complexes.
Physique des atomes et des molécules - une branche de la physique qui étudie la structure interne et propriétés physiques atomes, molécules et leurs associations plus complexes (clusters), ainsi que phénomènes physiques lors d'actes élémentaires d'interaction à basse énergie entre des objets avec des particules élémentaires.
Lors de l'étude de la physique des atomes et des molécules, les principales méthodes expérimentales sont la spectroscopie et la spectrométrie de masse avec toutes leurs variétés, certains types de chromatographie, les méthodes de résonance et la microscopie, méthodes théoriques mécanique quantique, physique statistique et thermodynamique. La physique des atomes et des molécules est étroitement liée à physique moléculaire, dans lequel les propriétés physiques (collectives) des corps dans divers états d'agrégation sont étudiées sur la base de l'examen de leur structure microscopique, ainsi qu'avec certaines branches de la chimie.
Dépensons brève digression dans l'histoire du développement de la théorie atomique-moléculaire :
Bibliographie
1. Leçon sur le thème "Molécules et atomes" S.V. Gromov, I.A. Patrie, professeurs de physique.
2. Leçon sur le thème «Structure de la matière» Fonin Ilya Alexandrovich, Kamzeeva Elena Evgenievna, professeur de physique, Gymnase n ° 8, Kazan.
3.G. Oster. La physique. Cahier de tâches. Aide bien-aimée.- M. : Rosmen, 1998.
4. Meyani A. Le grand livre expériences pour les écoliers. M.: "Rosmen". 2004
5.Physique Globale "Atomes et Molécules".
Edité et envoyé par Borisenko I.N.
Travail sur la leçon :
Gromov S.V.
Fonin I.A.
Les atomes sont de très petites particules, leur taille varie de un à cinq angströms (notée - Ao.). Un angström correspond à 10-10 mètres. La taille d'un cristal de sucre est d'environ 1 mm ; un tel cristal est environ 10 millions de fois plus gros que n'importe lequel de ses atomes constitutifs. Pour avoir une meilleure idée de la taille des atomes de particules, considérons cet exemple : si une pomme est agrandie à la taille le globe, alors un atome agrandi par le même facteur deviendra la taille d'une pomme moyenne.
Malgré leur petite taille, les atomes sont des particules plutôt complexes. Vous vous familiariserez avec la structure des atomes cette année, mais pour l'instant nous dirons seulement que tout atome est constitué de noyau atomique et liés coquille d'électrons, qui est aussi un système.
Un peu plus d'une centaine de types d'atomes sont actuellement connus. Parmi ceux-ci, environ quatre-vingts sont stables. Et à partir de ces quatre-vingts types d'atomes, tous les objets qui nous entourent sont construits dans toute leur infinie variété.
L'une des caractéristiques les plus importantes des atomes est leur tendance à se combiner les uns avec les autres. Le plus souvent, cela se traduit par molécules.
Une molécule peut contenir de deux à plusieurs centaines de milliers d'atomes. Dans le même temps, les petites molécules (diatomiques, triatomiques ...) peuvent également être constituées d'atomes identiques, tandis que les grandes, en règle générale, sont constituées d'atomes différents. Puisqu'une molécule est constituée de plusieurs atomes et que ces atomes sont connectés, la molécule est un système. Dans les solides et les liquides, les molécules sont connectées les unes aux autres, mais dans les gaz, elles ne le sont pas.
Les liaisons entre les atomes sont appelées liaisons chimiques , et des liaisons entre molécules liaisons intermoléculaires.
Les molécules liées entre elles forment substances.
Les substances composées de molécules sont appelées substances moléculaires. Ainsi, l'eau est composée de molécules d'eau, le sucre est composé de molécules de saccharose et le polyéthylène est composé de molécules de polyéthylène.
De plus, de nombreuses substances sont composées directement d'atomes ou d'autres particules et ne contiennent pas de molécules dans leur composition. Par exemple, l'aluminium, le fer, le diamant, le verre, le sel ne contiennent pas de molécules. De telles substances sont appelées non moléculaire.
Dans les substances non moléculaires, les atomes et autres particules chimiques, comme dans les molécules, sont interconnectés par des liaisons chimiques.La division des substances en moléculaires et non moléculaires est la classification des substances par type de bâtiment.
En supposant que les atomes interconnectés conservent une forme sphérique, il est possible de construire des modèles tridimensionnels de molécules et de cristaux non moléculaires. Des exemples de tels modèles sont présentés dans les Fig. 1.1.
La plupart des substances se trouvent généralement dans l'un des trois états agrégés: solide, liquide ou gazeux. Lorsqu'elles sont chauffées ou refroidies, les substances moléculaires peuvent passer d'un état d'agrégation à un autre. Ces transitions sont représentées schématiquement sur la Fig. 1.2.
Le passage d'une substance non moléculaire d'un état d'agrégation à un autre peut s'accompagner d'un changement de type de structure. Le plus souvent, ce phénomène se produit lors de l'évaporation de substances non moléculaires.
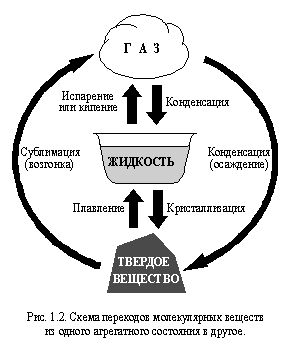
À fusion, ébullition, condensation et des phénomènes similaires qui se produisent avec les substances moléculaires, les molécules des substances ne sont pas détruites et ne se forment pas. Seules les liaisons intermoléculaires sont rompues ou formées. Par exemple, lorsque la glace fond, elle se transforme en eau et lorsque l'eau bout, elle se transforme en vapeur d'eau. Les molécules d'eau ne sont pas détruites dans ce cas et, par conséquent, en tant que substance, l'eau reste inchangée. Ainsi, dans les trois états d'agrégation, il s'agit de la même substance - l'eau.
Mais toutes les substances moléculaires ne peuvent pas exister dans les trois états d'agrégation. Beaucoup d'entre eux lorsqu'ils sont chauffés décomposer, c'est-à-dire qu'ils sont convertis en d'autres substances, tandis que leurs molécules sont détruites. Par exemple, la cellulose composant bois et papier) ne fond pas lorsqu'il est chauffé, mais se décompose. Ses molécules sont détruites et des molécules complètement différentes sont formées à partir des "fragments".
Alors, la substance moléculaire reste elle-même, c'est-à-dire chimiquement inchangée, tant que ses molécules restent inchangées.
Mais vous savez que les molécules sont en mouvement constant. Et les atomes qui composent les molécules bougent également (oscillent). Lorsque la température augmente, les vibrations des atomes dans les molécules augmentent. Peut-on dire que les molécules restent complètement inchangées ? Bien sûr que non! Qu'est-ce qui reste alors inchangé ? La réponse à cette question se trouve dans l'un des paragraphes suivants.
Eau. L'eau est la substance la plus connue et la plus répandue sur notre planète : la surface de la Terre est recouverte aux 3/4 d'eau, une personne est constituée à 65 % d'eau, la vie est impossible sans eau, puisque tous les processus cellulaires du corps se déroulent dans un milieu aqueux. la solution. L'eau est une substance moléculaire. C'est l'une des rares substances qui conditions naturelles se produit à l'état solide, liquide et gazeux, et est la seule substance pour laquelle chacun de ces états a son propre nom. Les particularités de la structure de l'eau sont causées par ses propriétés inhabituelles. Par exemple, lors de la congélation, l'eau augmente de volume, de sorte que la glace flotte dans sa fonte - eau liquide, et la densité d'eau la plus élevée est observée à 4 o C, de sorte qu'en hiver, les grands réservoirs ne gèlent pas au fond. L'échelle de température Celsius elle-même est basée sur les propriétés de l'eau (0 o - point de congélation, 100 o - point d'ébullition). Vous vous familiariserez avec les causes de ces phénomènes et les propriétés chimiques de l'eau en 9e année. |
Le fer- métal blanc argenté, brillant, malléable. Il s'agit d'une substance non moléculaire. Parmi les métaux, le fer se classe deuxième après l'aluminium en termes d'abondance dans la nature et premier en importance pour l'humanité. avec un autre métal - le nickel - il forme le noyau de notre planète. Le fer pur n'a pas de large application pratique. La célèbre colonne Kutub, située dans les environs de Delhi, haute d'environ sept mètres et pesant 6,5 tonnes, vieille de près de 2800 ans (elle a été installée au IXe siècle avant J.-C.) est l'un des rares exemples d'utilisation du fer pur (99,72 % ); il est possible que ce soit la pureté du matériau qui explique la durabilité et la résistance à la corrosion de cette structure. Sous forme de fonte, d'acier et d'autres alliages, le fer est littéralement utilisé dans toutes les branches de la technologie. Son précieux Propriétés magnétiques utilisé dans les générateurs électriques et les moteurs électriques. Le fer est un élément vital pour les humains et les animaux, car il fait partie de l'hémoglobine dans le sang. Avec sa carence, les cellules tissulaires reçoivent un apport insuffisant en oxygène, ce qui entraîne des conséquences très graves. |
Comme vous le savez déjà, les atomes sont identiques et différents. Vous apprendrez bientôt comment différents atomes diffèrent les uns des autres dans leur structure, mais pour l'instant nous dirons seulement que différents atomes diffèrent comportement chimique, c'est-à-dire sa capacité à se combiner les unes avec les autres, formant des molécules (ou des substances non moléculaires).
En d'autres termes, les éléments chimiques sont les mêmes types d'atomes qui ont été mentionnés dans le paragraphe précédent.
Chaque élément chimique a son propre nom, par exemple : hydrogène, carbone, fer, etc. De plus, chaque élément se voit également attribuer son propre symbole. Vous voyez ces symboles, par exemple, dans le "Tableau des éléments chimiques" dans la salle de chimie de l'école.
Un élément chimique est une collection abstraite. C'est le nom d'un nombre quelconque d'atomes d'un type donné, et ces atomes peuvent être n'importe où, par exemple : l'un sur Terre et l'autre sur Vénus. Un élément chimique ne peut pas être vu ou ressenti à la main. Les atomes qui composent un élément chimique peuvent ou non être liés les uns aux autres. Par conséquent, un élément chimique n'est ni une substance ni un système matériel.
Toutes les substances peuvent être solides, liquides et gazeuses. L'eau, la glace, la vapeur d'eau - ce sont tous des états différents de la même substance - l'eau. Qu'advient-il de l'eau lorsque nous la refroidissons ou la chauffons ? Pourquoi ses propriétés changent-elles autant ?
Tout les substances consistentà partir de nombreuses particules minuscules molécules et des particules encore plus petites atomes. Toutes les propriétés des substances dépendent de leur interaction. Les atomes et les molécules sont appelés particules de matière.
Ils ne peuvent être détectés qu'avec des instruments sophistiqués. Leurs propriétés sont très diverses. Le sucre se compose de certaines particules, le sel - d'autres, l'eau - de la troisième. Chaque substance a un grand nombre de molécules et encore plus d'atomes.
Les substances sont différentes. Dans la nature, on rencontre non seulement substances pures, constitués de particules identiques d'une substance (eau, sel, sucre). Essayons de mélanger de l'eau et de l'encre.
Quelle était la substance ? Ce liquide ne peut être appelé ni eau ni encre. ce mélange.
La matière dans la nature est très souvent à l'état de mélange. Par exemple, le sol. Il se compose des plus petits morceaux d'argile et de plus gros grains de sable et de pierres. Et il comprend également des restes de plantes pourries. Les sols sont un mélange de substances.
L'air ordinaire est aussi un mélange : il contient de nombreux gaz différents. Il y a de l'oxygène, que tous les organismes vivants respirent. Il y a du dioxyde de carbone que les plantes absorbent pour se former nutriments. Il y a aussi de la poussière dans l'air.
Pourquoi les solides, les liquides et les gaz sont-ils si différents les uns des autres ? Peut-être que leurs particules se comportent différemment ? Après tout, les propriétés des substances devraient dépendre de la relation entre les plus petits atomes et molécules.
En solides toutes les particules sont étroitement pressées les unes contre les autres. Cette disposition rappelle les athlètes dans un défilé.
dans les liquides les particules se déplacent librement les unes par rapport aux autres, comme les gens dans la rue. Donc, les liquides coulent, car on peut dire que la foule « coule » aussi le long de la rue.
Dans les gaz les particules sont très éloignées les unes des autres, comme de rares passants au petit matin. Par conséquent, les gaz sont facilement comprimés et condensés. matériel du site
Dans les solides, les particules semblent coller les unes aux autres. Pour les dégager et les tourner solide dans un liquide, vous devez le chauffer, c'est-à-dire ajouter de la chaleur. Et si vous ajoutez encore plus de chaleur, les particules commenceront à se déplacer rapidement et à se disperser dans différentes directions. En conséquence, le liquide se transformera en gaz. Rappelez-vous ce qui se passe lorsque les gens oublient de retirer une bouilloire bouillante du feu. Toute l'eau qu'il contient bout - elle se transforme en gaz et en plus petites gouttelettes d'eau.
Que se passe-t-il lorsque nous refroidissons de l'eau dans le réfrigérateur ? Privées de chaleur, les particules commencent à se connecter les unes aux autres - à se compacter, et l'eau se transforme en glace solide.
Sur cette page, du matériel sur les sujets :
Résumé du corps et de la substance
En quoi cela consiste. corps, atomes, molécules, substances
De quoi est faite la matière et comment se comportent les particules
-
La structure de la matière. 7e année
Malinovskaïa Natalya Vassilievna, professeur de physique
Article classé sous :Enseignement de la physique
Type de leçon : leçon d'apprentissage de nouveau matériel
Objectifs de la leçon:
Éducatif:étudier la signification des concepts - substance, substances simples, substances complexes, molécule (atome); étudier la composition des molécules (hydrogène, oxygène, eau).
Développement: développer l'observation, la parole compétente, former la capacité de tirer des conclusions à partir d'observations.
Éducateurs : cultiver l'intérêt pour l'étude de la physique, la diligence sur l'exemple de la vie des scientifiques
Équipement: Appareils et matériels de démonstration et d'expériences frontales : un verre d'eau, 3 verres vides, une bille d'acier, un anneau, une lampe à alcool, des aquarelles, de l'huile, un verre d'eau, Ballon ir, un flacon avec de l'eau, un bouchon et un tube de verre, un trépied, plusieurs modèles de réseaux cristallins ; pour chaque élève - une serviette, un flacon d'alcool (eau de Cologne), un verre d'eau, un grain de permanganate de potassium, 5 petits récipients, un verre de eau propre, modèles de molécules d'eau, réseaux cristallins spatiaux.
Pendant les cours.
I. Moment organisationnel -
saluer, préparer la classe pour la leçon; motivation pour les activités d'apprentissage.
II. Vérification des connaissances sur les sujets précédemment abordés
1 . - enquête frontale
Qu'est-ce que le « corps physique » ? ( chacun des corps qui nous entourent)
Qu'appelle-t-on "substance" en physique ? ( de quoi sont faits les corps physiques)
Qu'est-ce qu'un "phénomène" ? ( changements dans les corps physiques)
Donner des exemples de corps, nommer la substance dont le corps est composé (verre-verre)
- Nommer les phénomènes physiques fonte des glaces, chute des feuilles, orage)
- Qu'est-ce qui caractérise la température ? Avec quel instrument est-il mesuré ? ( température du corps, mesurée avec un thermomètre).
III. Étudier du nouveau matériel (méthode - une conversation avec la formulation de questions problématiques).
Présentation par le professeur.
Dans les temps anciens, la plupart des gens acceptaient les idées mythiques sur le monde comme une réalité incontestable. Mais déjà au YI siècle av. certaines personnes ont cessé de croire aux mythes et ont commencé à réfléchir de manière indépendante à des questions sur le monde qui les entoure et à y chercher des réponses.
Depuis l'Antiquité, l'homme a tenté d'expliquer tout ce qu'il rencontrait de mystérieux.Observant la nature, il a cherché à en dévoiler les secrets. Bien sûr, vous rencontrez chaque jour divers phénomènes physiques et, dans la plupart des cas, vous pouvez prédire comment ils se termineront. Essayez de prédire le résultat :
si vous lancez la balle, puis après un certain temps, elle ...
si vous déposez une goutte de peinture dans un verre d'eau, alors ...
Si vous faites chauffer de la glace...
Les corps qui nous entourent ont certaines propriétés : la brique est dure et la pâte à modeler est molle. Lorsqu'elle est chauffée, la glace fond et se transforme en eau. Pourquoi cela arrive-t-il? Comment les gens répondent-ils habituellement aux questions sur la nature des choses ? Qu'est-ce que c'est ça? C'est un clou. De quoi est-il fait ? Du fer. De quoi est composé le fer ? Le fer vient de zhedez, et c'est tout. Supposons que vous ayez besoin de concevoir un vaisseau spatial qui volera dans l'espace. Que devez-vous savoir pour cela ? ( propriétés des matériaux qui le composent). Et quelles connaissances faut-il avoir pour créer des matériaux aux propriétés souhaitées ? ( il faut connaître la structure de la matière).
Elaboration d'un schéma de la structure d'une substance :
CORPS - SUBSTANCE - ???
Énoncé de la question du problème - QUELLE EST LA STRUCTURE DE LA SUBSTANCE ?
Message sur le sujet et le but de la leçon.
Faisons quelques expériences.
1 expérience. Serrons le ballon avec nos mains. Que lui est-il arrivé? ( il a rétréci). Expliquer pourquoi? ( l'air est composé de particules, il y a des espaces entre elles).
2 expérience(frontal) - les élèves sont invités à déposer une goutte de liquide odorant (alcool, eau de Cologne) sur une feuille de serviette et à observer la tache sur le papier, puis à expliquer où la tache a disparu. ( l'alcool est constitué de particules qui ont quitté la surface de la serviette)
3 expérience- Prenons une boule de métal et un anneau, est-ce que la boule de métal passe facilement à travers l'anneau ? ( Oui). Tenons-le dans la flamme d'une lampe à alcool. La balle traverse-t-elle maintenant l'anneau ? ( Non).
Pourquoi? ( lorsqu'il est chauffé, le volume du corps a augmenté)
4 expérience. Nous fermons le flacon avec de l'eau avec un bouchon de liège dans lequel un tube de verre étroit est inséré. Lorsque l'eau dans le ballon est chauffée, le niveau d'eau dans le tube monte, lorsqu'il est refroidi, il diminue. C'est le principe de fonctionnement d'un thermomètre classique pour mesurer la température. Le tube du thermomètre contient du mercure ou de l'alcool. Conclusion : Les liquides se dilatent lorsqu'ils sont chauffés.
5 expérience(Nous entrerons le résultat dans un cahier d'exercices de physique, 7e année, p. 11. - division de la matière en plus petites particules). Dissolvez un petit grain de permanganate de potassium dans de l'eau versée dans un verre. Versez de l'eau colorée dans un autre verre et versez-y eau propre. Que voyons-nous ? ( la solution est moins colorée). Répétons l'étape précédente plusieurs fois. Que voyons-nous maintenant ? ( La solution est colorée encore plus faiblement). Quelle était la taille d'un grain de manganèse ? (elle est petite). Quelle est la propriété principale conservée en solution ( coloration).Que pouvez-vous dire de la taille des particules de manganèse qui se trouvent dans l'eau ? (Ils sont petits).
Décrire la structure de la matière... La matière est composée de particules individuelles.
Quelle est la taille de ces particules ? Les particules qui composent les substances sont très petites. Quel est le nombre de particules même dans une petite quantité de matière ? Il y a beaucoup de particules dans la matière.
Le nom de la plus petite particule de matière - molécule.
Quelle particule s'appelle une molécule? Molécule - la plus petite particule de matière .
Molécule - du latin "moles" - masse avec le suffixe diminutif "cula" - masse. Le terme lui-même est apparu en 1647 (scientifique français Pierre Gassendi).
La plus petite particule d'eau est une molécule d'eau. La plus petite particule de sel est une molécule de sel. Les molécules conservent les propriétés fondamentales de la matière. La molécule de sel est salée. La molécule de peinture verte est verte.
Pensez-vous que les molécules de différentes substances sont identiques ou non ? ( Non)
Que pouvez-vous dire des molécules d'une même substance ? La glace, l'eau et la vapeur d'eau sont constituées ou non des mêmes molécules ? (Oui).
Pourquoi? (Parce que c'est la même substance, mais sous une forme différente).
Conclusion: Les molécules de différentes substances sont différentes. Les molécules d'une même substance sont identiques.
Quelle est la taille des molécules ? On sait que la farine est obtenue à partir de blé. Une goutte d'huile, s'étalant à la surface de l'eau, peut former un film dont l'épaisseur est des dizaines de milliers de fois inférieure au diamètre d'un cheveu humain. Mais dans un grain d'eau et dans l'épaisseur d'un film d'huile il n'y a pas une, mais plusieurs molécules. Cela signifie que la taille des molécules de ces substances est encore plus petite que la taille d'un grain de farine et l'épaisseur du film. Essayons d'imaginer leurs tailles. Une molécule est autant de fois plus petite qu'une pomme de taille moyenne qu'une pomme est autant de fois plus petite que le globe.
Les molécules peuvent-elles être vues avec nos yeux ? ( Non)
Pourquoi? (ils sont très petits).
Cependant, il s'avère qu'il existe des particules qui, à leur tour, constituent des molécules - elles sont appelées atomes.
Conclusion: Les molécules sont constituées d'atomes .
Achèvement du schéma de la structure de la matière (écrire dans un cahier):
CORPS - SUBSTANCE - MOLÉCULES - ATOMES - ??? (à suivre…)
Dans les manuels de physique, classe 7, page 12, les élèves effectuent la tâche n ° 2 «Ajouter des phrases» - seuls, avec vérification ultérieure.
Informations de l'histoire: (la performance de l'élève avec du matériel pré-préparé est possible). L'ancien scientifique grec Démocrite a fait pour la première fois une brillante hypothèse selon laquelle tous les corps sont constitués des plus petites particules indivisibles et immuables - atomes, qui sont en mouvement et, en interaction les uns avec les autres, forment tous les corps de la nature. En observant divers phénomènes naturels, Démocrite est arrivé à la conclusion que les corps ne nous semblent que solides, mais en fait ils sont constitués des plus petites particules, mais ils sont si petits qu'il est impossible de les voir. Démocrite a supposé que dans différents corps, ces particules ont une forme différente. Il a appelé ces minuscules particules "atomes", ce qui signifie en grec "indivisibles". Ainsi, les anciens scientifiques ont exprimé de nombreuses idées modernes sur la structure de la matière. À cette époque, leurs déclarations n'étaient, bien sûr, que de brillantes suppositions basées sur des observations, mais non confirmées par des faits expérimentaux.
Répondez à la question : Nous ne voyons ni molécules ni atomes. Les corps nous paraissent solides. Comment leur existence a-t-elle été prouvée ? ( hypothèses ont été avancées sur la base d'expériences et d'observations). Seule la science du XXe siècle. fourni de nombreuses preuves directes de l'existence d'atomes et de molécules. Les atomes peuvent être vus dans les microscopes électroniques et ioniques les plus modernes !
Les atomes de chaque type sont généralement désignés par des symboles spéciaux. Par exemple : (nous écrivons au tableau et dans des cahiers) :"O est un atome d'oxygène, H est un atome d'hydrogène."
Les molécules sont également désignées par des symboles spéciaux. Explication de la structure des molécules d'eau à l'aide d'un modèle : considération de modèles de molécules d'eau.
- Il y a un peu plus de 100 atomes dans la nature, mais leurs combinaisons créent diverses substances qui nous entourent. Il y a 88 atomes dans la nature, le reste est obtenu en laboratoire. Il existe des molécules géantes qui contiennent des milliers et des centaines de milliers d'atomes. Ce sont des molécules de polymère. Les balles peuvent être utilisées pour construire des modèles de molécules.
- M.V. Lomonossov (1711-1765) - le grand éducateur et fondateur de la science en Russie, qui a fait de nombreuses découvertes dans de nombreux domaines scientifiques avec son travail titanesque, a écrit qu'une molécule peut être homogène et hétérogène.
Si une substance est constituée des mêmes molécules, on l'appelle Facile. Si une substance est constituée de molécules composées d'atomes différents, on l'appelle difficile. Il existe des corps dont les molécules sont constituées d'un atome (diamant, graphite), il existe des molécules constituées de deux atomes. Par exemple: O 2 est une molécule d'oxygène. Il est composé de 2 atomes d'oxygène. H 2 est une molécule d'hydrogène. Il est composé de 2 atomes d'hydrogène. H 2 O est une molécule d'eau. Il est composé de 2 atomes d'hydrogène et d'un atome d'oxygène. . En même temps, il existe des molécules géantes qui contiennent des milliers et des centaines de milliers d'atomes. Ce sont des molécules de polymère. Les balles peuvent être utilisées pour construire des modèles de molécules. (Démonstration de réseaux cristallins spatiaux).
Dans le monde moderne, en utilisant les derniers équipements, les propriétés de ces molécules géantes qui composent la substance "fullerène" ont été étudiées. .Matériels supplémentaires: les fullerènes sont un tout nouveau type de forme moléculaire du carbone. L'étudiant peut préparer à l'avance un court message contenant des informations sur l'histoire de la découverte des fullerènes, leurs propriétés structurelles, physiques et propriétés chimiques, ainsi que leurs domaines d'application.
Pensez-vous que les atomes sont les plus petites particules de matière ? ( les opinions peuvent être partagées, alors l'enseignant lui-même rend compte de la structure de l'atome). Il existe des particules encore plus petites (protons, neutrons, électrons) que vous découvrirez en 8e année.
Le résultat de l'étape d'étude du nouveau matériel- Quels nouveaux concepts avez-vous rencontrés lors de la leçon d'aujourd'hui ?
IV. Consolidation de l'étudié (enquête frontale).
De quoi est faite la substance ? (la matière est composée de particules)
Pourquoi les particules qui composent la matière ne sont-elles pas visibles à l'œil nu ? ils sont très petits)
Que savez-vous du nombre de particules qui composent une substance ? ( Il y en a beaucoup).
Que deviennent les corps lorsqu'ils sont chauffés ? Au refroidissement ? ( les corps se dilatent lorsqu'ils sont chauffés, se contractent lorsqu'ils sont refroidis
Expliquez ces déclarations en termes de structure interne de la matière.
Donnez des exemples de votre expérience de la vie, prouvant ces affirmations ( les élèves donnent des exemples tirés de leur propre expérience.
Réalisation des tâches de la collection de problèmes de physique, V.I. Lukashik n ° 40, 43, 44, 45, 49, 50 - solution orale de problèmes qualitatifs.
V. Vérification de l'assimilation du matériel étudié.
Travail indépendant à court terme (avec auto-examen ultérieur et notation pour le travail
5 bonnes réponses - score "5"
4 bonnes réponses - score "4"
3 bonnes réponses - cochez "3"
si 2 ou 1 est la bonne réponse, il faut répéter le matériel étudié
Mettez sur les feuilles de papier avec les tâches données "+" si la réponse est "oui", "-" si la réponse est "non".
j'option
La matière est composée de petites particules que l'on peut voir - (Non).
Les molécules d'eau froide et chaude sont différentes - (Non).
Lorsqu'une substance est chauffée, les écarts entre ses particules augmentent + (Oui).
Les atomes sont constitués de molécules - (Non).
Une molécule d'hydrogène est composée de deux atomes d'hydrogène + (oui)
Option II
Le volume du corps diminue lorsqu'il est chauffé - (Non).
Lorsqu'un gaz est comprimé, la taille des molécules diminue - (Non).
Les molécules de vapeur d'eau sont différentes des molécules d'eau - (Non).
Les molécules sont constituées d'atomes + (Oui).
Une molécule d'oxygène est composée de deux atomes d'oxygène + (oui)
V. Devoirs (avec commentaire, différencié)
Pour tous - Étudiez les paragraphes 7, 8, répondez aux questions.
Pour ceux qui le souhaitent - Réaliser une maquette d'une molécule d'eau
Faire une expérience avec une goutte d'huile (meilleure que l'huile de machine) pour déterminer la taille de la molécule d'huile,
Rédigez un mini-essai "Dans le monde des molécules".
VI. Résumé de la leçon.
Réflexion (qu'est-ce qui n'était pas clair, qu'est-ce que vous avez aimé dans la leçon, qu'est-ce que vous n'avez pas aimé ?)
Noter une leçon.
Littérature:
Kabardin O.F. L'histoire du développement de la physique et du développement des idées sur le monde : un cours au choix : 10e-11e année : manuel / O.F. Kabardin. - M., Astrel : Transitbook, 2005. - 318, p. : ill.
Cahier d'exercices de physique: 7e année: au manuel de A. V. Peryshkin "Physics Grade 7" / R. D. Minkova, V. V. Ivanova. - 2e éd., stéréotype. - M.: Maison d'édition "Examen", 2010. - 142, p.
Collection de problèmes de physique: 7-9 cellules: aux manuels de A. V. Peryshkin et autres. "Physique. 7e année », « Physique. 8e année », « Physique. 9e année "/ A. V. Peryshkin; Comp. N.V. Filonovich.-5e éd., stéréotype. - M.: Maison d'édition "Examen", 2010. - 190,
Recueil de problèmes de physique. De la 7e à la 9e année : un guide pour les élèves de l'enseignement général. institutions / V. I. Lukashik, E. V. Ivanova. – 24e éd. – M. : Lumières, 2010. – 240 p. : ill.
Développements de leçons universelles en physique : 7e année. - 2e éd., révisée. Et extra. - M. : VAKO, 2010. - 304 p. - (Pour aider l'instituteur).
La physique. 7e année: manuel d'enseignement général. établissements/A. V. Perychkine. - 14e éd., stéréotype. - M. Outarde, 2010. - 192 p. : ill.
