Цели на урока:
- разкажете на учениците за молекулите и атомите и ги научете да правят разлика между тях.
Цели на урока:
Образователни: Разгледайте нов материална тема "Молекули и атоми";
Развитие: насърчаване на развитието на мисленето и когнитивните умения; овладяване на методите за синтез и анализ;
Образователни: насърчаване на положителна мотивация за учене.
Основни термини:
Молекула- електрически неутрална частица, която се състои от два или повече свързани атома ковалентни връзки; най-малката частица от вещество, което притежава неговите свойства.
атом- най-малката химически неделима част от елемента, която е носител на неговите свойства; се състои от електрони и атомно ядро. Различно количестворазлични атоми, свързани с междуатомни връзки, образуват молекули.
Атомно ядро- централната част на атома, в която е концентрирано повече от 99,9% от масата му.
3.Защо частиците, които съставят, не се виждат? вещество?
4.Как да обясним изсушаването на прането след пране?
5 защо твърдите частици изглеждат твърди?
Молекули.
2. Какви са имената на частиците, които изграждат молекулите?
3. Опишете експеримента, с който можете да определите размера на молекулата.
4. Различават ли се молекулите на едно вещество в различните си агрегатни състояния?
5.Какво е атом и от какво е направен
Домашна работа.
Опитайте се да проведете експеримент у дома, за да измерите размера на молекулата на всяко вещество.
Интересно е да знам какво.
Концепцията за атома като най-малката неделима част от материята е формулирана за първи път от древноиндийски и древногръцки философи. През XVII и XVIII векхимиците успяха да потвърдят експериментално тази идея, показвайки, че някои вещества не могат да бъдат допълнително разградени до съставните им елементи с помощта на химически методи. Въпреки това, в края на 19-ти и началото на 20-ти век физиците откриват субатомни частици и сложната структура на атома и става ясно, че атомът всъщност не е „неделим“.
На международния конгрес на химиците в Карлсруе (Германия) през 1860 г. са приети дефиниции на понятията молекула и атом. Атомът е най-малката частица от химичен елемент, който е част от прости и сложни вещества.
Физика на атомите и молекулите - клон на физиката, който изучава вътрешната структура и физични свойстваатоми, молекули и техните по-сложни асоциации (клъстери), както и физически явленияпри нискоенергийни елементарни актове на взаимодействие на обекти един с друг с елементарни частици.
При изучаването на физиката на атомите и молекулите основните от тях са експериментални методи като спектроскопия и масспектрометрия с всичките им разновидности, някои видове хроматография, резонансни методи и микроскопия, теоретични методиквантова механика, статистическа физика и термодинамика. Физиката на атомите и молекулите е тясно свързана с молекулярна физика, в който се изучават (колективните) физични свойства на телата в различни агрегатни състояния на базата на изследване на тяхната микроскопска структура, както и с някои раздели от химията.
Да похарчим кратка екскурзияв историята на развитието на атомно-молекулярната теория:
Библиография
1. Урок на тема "Молекули и атоми" S.V. Громов, И.А. Родина, учител по физика.
2. Урок на тема "Структура на материята" Фонин Иля Александрович, Камзеева Елена Евгениевна, учител по физика, МОУ гимназия №8, Казан.
3.G. Остър. Физика. Проблемна книга. Любим водач. - М .: Росмен, 1998.
4. Меяни А. Голямата Книгаексперименти за ученици. М .: "Росмен". 2004 г.
5.Глобална физика "Атоми и молекули".
Редактирано и изпратено от Борисенко I.N.
Работи върху урока:
Громов С.В.
Фонин И.А.
Атомите са много малки частици с размери от един до пет ангстрьома (означени с Ao.). Един ангстрьом е 10-10 метра. Размерът на захарния кристал е приблизително 1 mm, такъв кристал е приблизително 10 милиона пъти по-голям от всеки от съставните му атоми. За да получите по-добра представа колко малки частици са атомите, помислете за този пример: ако увеличите ябълка до размера Глобусът, тогава атомът, увеличен със същия коефициент, става с размерите на средна ябълка.
Въпреки малкия си размер, атомите са доста сложни частици. Тази година ще се запознаете със структурата на атомите, но засега нека кажем, че всеки атом се състои от атомно ядрои свързани електронна обвивка, тоест също е система.
В момента са известни малко над сто вида атоми. От тях около осемдесет са стабилни. И от тези осемдесет вида атоми всички обекти около нас са изградени в цялото им безкрайно разнообразие.
Една от най-важните характеристики на атомите е тяхната склонност да се свързват един с друг. Най-често това се формира молекули.
Една молекула може да съдържа от две до няколкостотин хиляди атома. В същото време малките молекули (двуатомни, триатомни ...) също могат да се състоят от едни и същи атоми, а големите, като правило, се състоят от различни атоми. Тъй като една молекула се състои от няколко атома и тези атоми са свързани, молекулата е система.В твърдите тела и течностите молекулите са свързани помежду си, а в газовете не са.
Връзките между атомите се наричат химически връзки и връзките между молекулите - междумолекулни връзки.
Молекулите, свързани заедно, се образуват вещества.
Веществата, състоящи се от молекули, се наричат молекулярни вещества... И така, водата се състои от водни молекули, захарта - от молекули захароза, а полиетиленът - от полиетиленови молекули.
Освен това много вещества се състоят директно от атоми или други частици и не съдържат молекули. Например, те не съдържат молекули алуминий, желязо, диамант, стъкло, готварска сол. Такива вещества се наричат немолекулни.
В немолекулните вещества атомите и другите химични частици, както и в молекулите, са свързани с химични връзки.Разделянето на веществата на молекулярни и немолекулни е класификация на веществата по вид структура.
Ако приемем, че свързаните атоми запазват сферичната си форма, е възможно да се конструират триизмерни модели на молекули и немолекулни кристали. Примери за такива модели са показани на фиг. 1.1.
Повечето вещества обикновено се намират в едно от трите агрегатни състояния: твърдо, течно или газообразно. При нагряване или охлаждане молекулярните вещества могат да преминат от едно агрегатно състояние в друго. Такива преходи са показани схематично на фиг. 1.2.
Преходът на немолекулно вещество от едно агрегатно състояние в друго може да бъде придружено от промяна в вида на структурата. Най-често това явление възниква по време на изпаряване на немолекулни вещества.
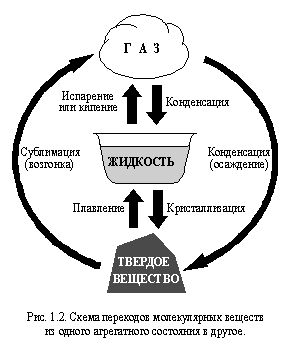
В топене, кипене, кондензацияи подобни явления, възникващи с молекулярни вещества, молекулите на веществата не се разрушават или образуват. Само междумолекулните връзки се прекъсват или образуват. Например, ледът, когато се разтопи, се превръща във вода, а водата, когато се вари, се превръща във водна пара. В този случай водните молекули не се разрушават и следователно като вещество водата остава непроменена. Така и в трите агрегатни състояния това е едно и също вещество - вода.
Но не всички молекулярни вещества могат да съществуват и в трите агрегатни състояния. Много от тях при нагряване разлагам, тоест те се превръщат в други вещества, докато техните молекули се разрушават. Например целулоза (основна компонентдърво и хартия) не се топи при нагряване, а се разлага. Молекулите му се разрушават, а от „фрагментите“ се образуват съвсем различни молекули.
Така, едно молекулно вещество остава себе си, тоест химически непроменено, докато неговите молекули остават непроменени.
Но знаете, че молекулите са в постоянно движение. А атомите, които съставляват молекулите, също се движат (вибрират). С повишаване на температурата вибрациите на атомите в молекулите се засилват. Можем ли да кажем, че молекулите остават напълно непроменени? Разбира се, че не! Какво тогава остава непроменено? Отговорът на този въпрос е в един от следващите параграфи.
Вода.Водата е най-известното и много разпространено вещество на нашата планета: повърхността на Земята е 3/4 покрита с вода, човек е 65% вода, животът е невъзможен без вода, тъй като всички клетъчни процеси на тялото се извършват в воден разтвор. Водата е молекулярно вещество. Това е едно от малкото вещества, които природни условиясе среща в твърдо, течно и газообразно състояние и е единственото вещество, за което всяко от тези състояния има собствено име. Особеностите на структурата на водата се дължат на необичайните й свойства. Например, когато водата замръзне, тя се увеличава в обема си, така че ледът плува в нейната стопилка - течна вода, а най-високата плътност на водата се наблюдава при 4 o С, така че през зимата големите резервоари не замръзват до дъното. Самата температурна скала по Целзий се основава на свойствата на водата (0 o - точка на замръзване, 100 o - точка на кипене). С причините за тези явления и с химичните свойства на водата ще се запознаете в 9. клас. |
Желязо- сребристо бял, лъскав, ковък метал. Това е немолекулно вещество. Сред металите желязото се нарежда на второ място след алуминия по разпространение в природата и на първо място по важност за човечеството. заедно с друг метал - никел - образува ядрото на нашата планета. Чистото желязо няма широк практическо приложение... Известната колона Кутуб, намираща се в околностите на Делхи, висока около седем метра и тежаща 6,5 тона, има възраст от почти 2800 години (издигната е през 9 век пр.н.е.) е един от малкото примери за използването на чисто желязо (99,72 %); възможно е точно чистотата на материала да обяснява издръжливостта и устойчивостта на корозия на тази конструкция. Под формата на чугун, стомана и други сплави желязото се използва буквално във всички клонове на техниката. Неговото ценно магнитни свойстваизползвани в генератори и електродвигатели. Желязото е жизненоважен елемент за хората и животните, тъй като е част от хемоглобина на кръвта. При липсата му тъканните клетки получават недостатъчно кислород, което води до много сериозни последици. |
Както вече знаете, атомите са еднакви и различни. Скоро ще разберете как различните атоми се различават един от друг по структура, но засега нека просто кажем, че различните атоми се различават химическо поведение, тоест способността му да се комбинира помежду си, образувайки молекули (или немолекулни вещества).
С други думи, химическите елементи са самите видове атоми, които бяха споменати в предишния параграф.
Всеки химичен елементима собствено име, например: водород, въглерод, желязо и т.н. Освен това на всеки елемент се присвоява собствено символ... Можете да видите тези символи, например, в "Таблица на химичните елементи" в класната стая по химия в училище.
Химическият елемент е абстрактен агрегат. Това е името на произволен брой атоми от даден тип и тези атоми могат да бъдат навсякъде, например: единият е на Земята, а другият е на Венера. Химически елемент не може нито да се види, нито да се докосне с ръце. Атомите, които съставляват химичен елемент, могат или не могат да бъдат свързани помежду си. Следователно химичният елемент не е нито вещество, нито материална система.
Всички вещества могат да бъдат твърди, течни и газообразни. Вода, лед, водна пара - всичко това са различни състояния на едно и също вещество - вода. Какво се случва с водата, когато я охлаждаме или загряваме? Защо свойствата му се променят толкова много?
Всичко вещества се състоятот много малки частици - молекулии още по-малки частици - атоми.Всички свойства на веществата зависят от тяхното взаимодействие. Атомите и молекулите се наричат частици материя.
Те могат да бъдат открити само със сложни инструменти. Те са много разнообразни по своите свойства. Захарта се състои от едни частици, сол от други, вода от други. Всяко вещество съдържа огромен брой молекули и дори повече атоми.
Веществата са различни. В природата се срещаме не само чисти вещества,които се състоят от еднакви частици материя (вода, сол, захар). Нека опитаме да смесим вода и мастило.
Какво е веществото? Тази течност не може да се нарече вода или мастило. Това смес.
Вещество в природата много често е в смесено състояние. Например почвата. Състои се от най-малките бучки глина и по-едри песъчинки и камъни. И включва също изгнили растителни остатъци. Почвата е смес от вещества.
Обикновеният въздух също е смес: съдържа много различни газове. Има кислород, който всички живи организми дишат. Има въглероден диоксид, който растенията поглъщат, за да се образуват хранителни вещества... Във въздуха също има прах.
Защо твърдите тела, течностите и газовете са толкова различни един от друг? Може би техните частици се държат по различен начин? В крайна сметка свойствата на веществата трябва да зависят от връзката на най-малките атоми и молекули.
В твърди веществавсички частици са здраво притиснати една към друга. Тази подредба напомня на спортисти в парад.
В течностичастиците се движат свободно една спрямо друга, като хората на улицата. Следователно текат течности, защото може да се каже, че тълпата „тече“ по улицата.
В газовечастиците са много далеч една от друга, като редки минувачи рано сутрин. Ето защо газовете лесно се компресират и кондензират. Материал от сайта
В твърдите тела частиците сякаш се придържат една към друга. Да ги откача и да ги завърти твърдов течността, трябва да я загреете, тоест да добавите топлина. И ако добавите още повече топлина, тогава частиците ще започнат да се движат бързо и да се разпръснат в различни посоки. В резултат на това течността ще се превърне в газ. Спомнете си какво се случва, когато хората забравят да свалят врящ чайник от печката. Цялата вода в него изпарява - превръща се в газ и малки капчици вода.
Какво се случва, когато охладим водата в хладилника? Лишени от топлина, частиците започват да се комбинират помежду си - да кондензират, а водата се превръща в твърд лед.
На тази страница материали по теми:
Абстракт на тяло и субстанция
Какво е какво. тела, атоми, молекули, вещества
От какви вещества са направени и как се държат частиците
-
Структурата на материята. 7-ми клас
Малиновская Наталия Василиевна, учител по физика
Статията принадлежи към раздела:Преподаване по физика
Тип урок:урок за изучаване на нов материал
Цели на урока:
Образователни:да изучават значението на понятията – вещество, прости вещества, сложни вещества, молекула (атом); изучаване на състава на молекулите (водород, кислород, вода).
Разработване:развиват наблюдение, компетентна реч, формират способността да се правят изводи от наблюденията.
Образование:да се насърчи интерес към изучаването на физиката, упорита работа чрез пример от живота на учените
Оборудване: Устройства и материали за демонстрация и фронтални експерименти: чаша вода, 3 празни чаши, стоманена топка, пръстен, спиртна лампа, акварели, масло, чаша вода, балон IR, колба с вода, запушалка и стъклена тръба, статив, няколко модела кристални решетки; за всеки ученик - салфетка, бутилка алкохол (одеколон), чаша вода, зърно калиев перманганат, 5 малки съда, чаша чиста вода, модели на водни молекули, пространствени кристални решетки.
По време на занятията.
I. Организационен момент -
поздрав, подготовка на класа за урока; мотивация за учебни дейности.
II. Тестване на знанията по вече обхванати теми
1 ... - фронтална анкета
Какво се нарича "физическо тяло"? ( всяко от телата около нас)
Какво се нарича "материя" във физиката? ( от какво са направени физическите тела)
Какво е "феномен"? ( промени, настъпващи с физическите тела)
Дайте примери за тела, назовете веществото, което изгражда тялото (стъкло - стъкло)
- Какви са физическите явления ( топящ се лед, падащи листа, гръмотевична буря)
- Какво характеризира температурата? С какъв уред се измерва? ( степента на телесна топлина, измерена с термометър).
III. Изучаване на нов материал (метод - разговор с формулиране на проблемни въпроси).
Встъпително слово на учителя.
В древни времена повечето хора приемаха митичните представи за света като реалност, която не предизвиква съмнения. Но още през YI век пр.н.е. някои хора спряха да вярват в митовете и започнаха самостоятелно да разсъждават върху въпросите за света около тях и да търсят отговори на тях.
Дълго време човекът се опитваше да обясни всичко мистериозно, което среща.Наблюдавайки природата, той се опитваше да разкрие нейните тайни. Разбира се, всеки ден се сблъсквате с различни физически явления и в повечето случаи можете да предвидите как ще завършат те. Опитайте се да предвидите резултата:
ако хвърлите топката нагоре, след известно време ...
ако пуснете капка боя в чаша вода, тогава ...
ако загрееш леда, тогава...
Телата около нас имат определени свойства: тухлата е твърда, а пластилинът е мек. При нагряване ледът се топи и се превръща във вода. Защо се случва това? Как хората обикновено отговарят на въпроси за естеството на нещата? Какво е това? Това е пирон. И от какво е направен? От желязо. И от какво е направено желязото? Желязо - от желязо, това е всичко. Да предположим, че трябва да проектирате космически кораб, който ще лети в космоса, какво трябва да знаете, за да направите това? ( Свойства на материалите, от които трябва да се състои).Какви знания трябва да имате, за да създавате материали с желани свойства? ( трябва да знаете структурата на материята).
Изготвяне на диаграма на структурата на материята:
ТЯЛО - ВЕЩЕСТВО - ???
Формулиране на проблемния въпрос – КАКВА Е СТРУКТУРАТА НА ВЕЩЕСТВОТО?
Съобщаване на темата и целта на урока.
Нека проведем някои експерименти.
1 опит.Нека стиснем балона с ръце. Какво му се случи? ( намаля по обем).Обясни защо? ( въздухът е направен от частици, между тях има пролуки).
2 опит(фронтално) - учениците трябва да капнат капка миризлива течност (алкохол, одеколон) върху лист салфетка и да наблюдават петното върху хартията и след това да обяснят къде е изчезнало петното. ( алкохолът се състои от частици, които са напуснали повърхността на салфетката)
3 опит- Вземете метална топка и пръстен Металната топка лесно ли минава през ринга? ( да). Нека го държим в пламъка на алкохолна лампа. Сега топката минава ли през ринга? ( Не).
Защо? ( при нагряване обемът на тялото се увеличава)
4 опит.Затваряме колбата с вода със запушалка, в която се поставя тясна стъклена тръба. Когато водата в колбата се нагрява, нивото на водата в тръбата се повишава; когато се охлади, то намалява. Това е в основата на принципа на действие на конвенционален термометър за измерване на температура. В тръбата на термометъра има живак или алкохол. Заключение : Течностите се разширяват при нагряване.
5 опит(резултатът ще бъде въведен в работна тетрадка по физика, 7 клетки, стр. 11. - разделянето на материята на най-малките частици). Разтворете малко зърно калиев перманганат във вода, излята в чаша. Изсипете малко цветна вода в друга чаша и изсипете в нея чиста вода... какво виждаме? ( разтворът се оцветява по-слабо). Нека повторим предишната стъпка няколко пъти. Какво виждаме сега? ( Разтворът се оцветява още по-слабо).Какъв беше размерът на мангановото зърно? (тя е малка).Какво е основното свойство, запазено в разтвора ( оцветяванеКакво можете да кажете за размера на частиците манган, които са във водата? (Те са малки.)
Направете заключение за структурата на материята... Веществото е съставено от отделни частици.
Какви са размерите на тези частици? Частиците, които съставляват веществото, са много малки. Колко частици има дори в малко количество материя? В веществото има много частици.
Име на най-малката частица материя - молекула.
Коя частица се нарича молекула? Молекула - най-малката частица материя .
Молекула - от латински "moles" - маса с умалителен суфикс "cula" - маса. Самият термин се появява през 1647 г. (френският учен Пиер Гасенди).
Най-малката частица вода е водна молекула. Най-малката частица сол е молекула на солта. Молекулите запазват основните свойства на веществото. Молекулата на солта е солена. Молекулата на зелената боя е зелена.
Мислите ли, че молекулите на различните вещества са еднакви или не? ( Не)
Какво можете да кажете за молекулите на едно и също вещество?Лед, вода и водна пара са съставени от едни и същи молекули или не? (Да).
Защо? (Защото е едно и също вещество, но в различна форма).
заключение: Молекулите на различните вещества са различни. Молекулите на едно вещество са еднакви.
Какви са размерите на молекулите? Известно е, че брашното се получава от пшеница. Капка масло, разстилаща се по повърхността на водата, може да образува филм, чиято дебелина е десетки хиляди пъти по-малка от диаметъра на човешката коса. Но в зърно вода и в дебелината на маслен филм има не една, а много молекули. Това означава, че размерът на молекулите на тези вещества е дори по-малък от размера на зърно брашно и дебелината на филма. Нека се опитаме да си представим техните размери. Молекулата е толкова пъти по-малка от една средно голяма ябълка, колкото пъти ябълката е по-малка от земното кълбо.
Можем ли да видим молекули с очите си? ( Не)
Защо? (размерът им е много малък).
Въпреки това се оказва, че има частици, от които от своя страна са съставени молекули - те се наричат атоми.
заключение: Молекулите са изградени от атоми .
Завършване на схемата на структурата на материята (запишете в тетрадка):
ТЯЛО - ВЕЩЕСТВО - МОЛЕКУЛИ - АТОМИ - ??? (следва продължение…)
В работните тетрадки по физика за 7 клас, стр. 12 учениците изпълняват задача номер 2 „Добавяне на изречения“ – самостоятелно, с последваща проверка.
Информация от историята: (ученик може да говори с предварително подготвен материал). Древногръцкият учен Демокрит е първият, който изрази гениалното предположение, че всички тела се състоят от най-малките неделими и неизменни частици - атоми,които са в движение и, взаимодействайки помежду си, образуват всички тела на природата. Наблюдавайки различни природни явления, Демокрит стига до убеждението, че телата ни изглеждат само твърди, всъщност те се състоят от най-малките частици, но са толкова малки, че е невъзможно да ги видим. Демокрит приема, че различните тела имат тези частици с различна форма. Той нарече тези малки частици „атоми“, което на гръцки означава „неделими“. Така древните учени изразяват голяма част от съвременните концепции за структурата на материята. По това време техните твърдения, разбира се, бяха само гениални предположения, основани на наблюдения, но не и потвърдени от никакви експериментални факти.
Отговорете на въпроса: Ние не виждаме молекули или атоми. Телата ни изглеждат твърди. Как беше доказано тяхното съществуване? ( хипотезите са изразени въз основа на експерименти и наблюдения)... Единствената наука на XX век. е предоставил множество преки доказателства за съществуването на атоми и молекули. Атомите могат да се видят в най-модерните електронни и йонни микроскопи!
Обичайно е атомите от всеки тип да се обозначават със специални символи. Например: (пишете на дъската и в тетрадките):"О е кислороден атом, Н е водороден атом."
Молекулите също се идентифицират със специални символи. Обясняване на структурата на водните молекули с помощта на модел: Разглеждане на модели на водни молекули.
- В природата има малко повече от 100 атома, но техните комбинации създават различни вещества, които ни заобикалят. В природата има 88 атома, останалите се получават в лаборатории. Има гигантски молекули, които съдържат хиляди и стотици хиляди атоми. Това са полимерни молекули. Топките могат да се използват за конструиране на молекулярни модели.
- М.В. Ломоносов (1711-1765) - великият просветител и основател на науката в Русия, който със своята титанична работа направи много открития в много области на науката, пише, че една молекула може да бъде хомогенна и разнородна.
Ако някое вещество се състои от едни и същи молекули, тогава то се нарича просто.Ако веществото се състои от молекули, изградени от различни атоми, то се нарича сложен... Има тела, чиито молекули се състоят от един атом (диамант, графит), има молекули, състоящи се от два атома. Например: O 2 е кислородна молекула. Състои се от 2 кислородни атома. Н2 е водородна молекула. Състои се от 2 водородни атома. H2O е водна молекула. Състои се от 2 водородни атома и един кислороден атом. ... В същото време има гигантски молекули, които съдържат хиляди и стотици хиляди атоми. Това са полимерни молекули. Топките могат да се използват за конструиране на молекулярни модели. (Демонстрация на пространствени кристални решетки).
В съвременния свят, използвайки най-новото оборудване, са изследвани свойствата на такива гигантски молекули, които съставляват веществото "фулерен". .Допълнителен материал:фулерените са напълно нов вид молекулярна форма на въглерод. Студентът може предварително да подготви малко съобщение с информация за историята на откриването на фулерените, техните структурни, физически и химични свойства, както и техните области на приложение.
Мислите ли, че атомите са най-малките частици на материята? ( мненията могат да бъдат разделени, тогава самият учител докладва за структурата на атома).Има дори по-малки частици (протони, неутрони, електрони), за които ще научите в 8 клас.
Резултатът от етапа на изучаване на нов материал- Какви нови понятия срещнахте в урока днес?
IV. Консолидиране на наученото (фронтална анкета).
От какво е направено веществото? (вещество се състои от частици)
Защо частиците, които съставляват веществото, не могат да се наблюдават с просто око?, ( те са много малки)
Какво знаете за броя на частиците, които изграждат дадено вещество? ( има много от тях).
Какво се случва с телата, когато се нагряват? При охлаждане? ( при нагряване телата се разширяват, при охлаждане се свиват)
Обяснете тези твърдения от гледна точка на вътрешната структура на веществото.
Дайте примери от вашите житейски опитдоказване на тези твърдения ( учениците дават примери от собствения си опит).
Изпълнявайки задачи от сборник задачи по физика, V.I. Лукашик №№ 40, 43, 44, 45, 49, 50 - устно решаване на проблеми с качеството.
V. Проверка на усвояването на изучавания материал.
Краткосрочна самостоятелна работа (с последваща самопроверка и присвояване на оценки за работа
5 верни отговора - оценка "5"
4 верни отговора - оценка "4"
3 верни отговора - оценка "3"
ако 2 или 1 верен отговор - необходимо е да се повтори изучавания материал
Поставете върху листовете хартия със зададените задачи "+", ако отговорът е "да", "-", ако отговорът е "не".
Вариант I
Веществото е съставено от малки частици, които могат да се видят - (Не).
Молекулите на студената и горещата вода са различни - (Не).
Когато веществото се нагрява, пролуките между неговите частици се увеличават + (Да).
Атомите са направени от молекули - (Не).
Водородната молекула се състои от два водородни атома + (да)
Вариант II
Обемът на тялото намалява при нагряване - (Не).
Когато газът се компресира, размерът на молекулите намалява - (Не).
Молекулите на водната пара са различни от водните молекули - (Не).
Молекулите са изградени от атоми + (Да).
Кислородната молекула се състои от два кислородни атома + (да)
V. Домашна работа (с коментар, диференцирана)
Всички - Проучете параграфи 7, 8, отговорете на въпроси.
За желаещите - Направете модел на водна молекула
Проведете експеримент с капка масло (по-добро от машинно масло), за да определите размера на маслената молекула,
Напишете мини-есе „В света на молекулите“.
Vi. Резюме на урока.
Рефлексия (кое не беше ясно, какво ви хареса в урока, какво не ви хареса?)
Оценяване на урок.
литература:
О.Ф.Кабардин Историята на развитието на физиката и развитието на идеите за света: избираем курс: 10-11 клас: учебник / О. Ф. Кабардин. - М., Астрел: Транзиткнига, 2005. - 318, с,: ил.
Работна тетрадка по физика: 7 клас: към учебника на А. В. Перишкин "Физика 7 клас" / Р. Д. Минкова, В. В. Иванова.-2-ро изд., Стереотип. - М .: Издателство "Изпит", 2010. - 142, с.
Сборник със задачи по физика: 7-9 клас: към учебниците на A. V. Peryshkin и др. „Физика. 7 клас, "Физика. 8 клас, "Физика. 9 клас "/ A. V. Peryshkin; Съставено от Н. В. Филонович.-5-то изд., Стереотип. - М .: Издателство "Изпит", 2010. - 190,
Колекция от задачи по физика. 7-9 клас: помагало за общообразователни ученици. институции / В. И. Лукашик, Е. В. Иванова. - 24-то изд. - М .: Образование, 2010 .-- 240 с .: ил.
Универсална разработка на уроци по физика: 7 клас. - 2-ро изд., преп. И добавете. - М .: ВАКО, 2010 .-- 304 с. - (За да помогне на учителя).
Физика. 7 клас: учебник за общообразователна подготовка. институции / А. В. Перишкин. - 14-то изд., Стереотип. - М. Дрофа, 2010 .-- 192 с.: Ил.
